Small Vessel Disease (SVD)
Wat is SVD
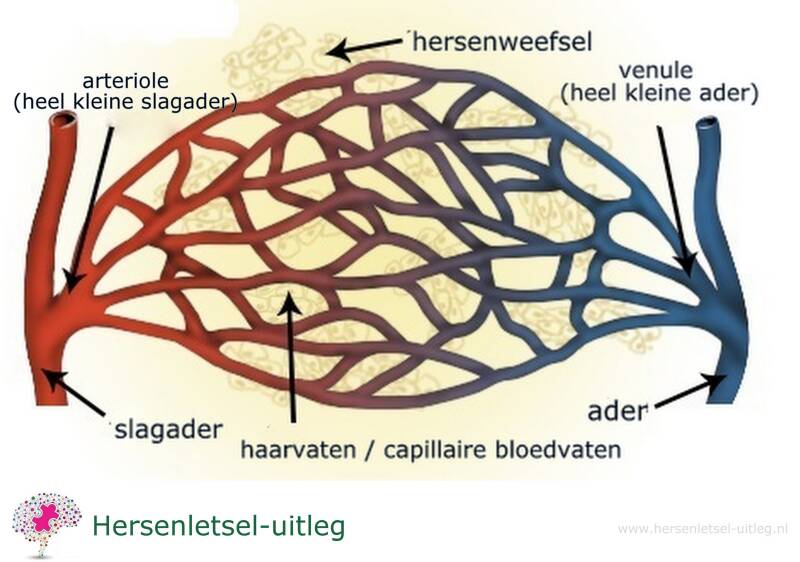
Small Vessel Disease (SVD), ook wel bekend als cerebrale microangiopathie, is een term voor schade aan de hersenen die ontstaat door problemen met de kleine bloedvaatjes: de kleine slagaders, arteriolen, haarvaten, venulen of aderen.
Het is de belangrijkste oorzaak van vasculaire dementie, cognitieve stoornissen, en 5% van alle herseninfarcten en hersenbloedingen (ischemische en hemorragische beroertes).
Deze schade aan de kleine bloedvaten zorgt voor verminderde of onderbroken bloedtoevoer (perfusie) naar de hersenen. Naast de hersenen kunnen ook nieren of het netvlies aangetast worden. SVD behoort tot de cerebrovasculaire ziekten (aandoeningen van hersenbloedvaten).
De kleine bloedvaatjes in de hersenen kunnen beschadigd raken door microbloedinkjes of door bloedpropjes die vastlopen.
Deze kleine schade aan de kleinste bloedvaten in de hersenen kan omliggende zenuwen aantasten. Een probleem in een deel van de hersenen kan zich uitbreiden en schade aan de rest van de hersenen veroorzaken. Dit kan leiden tot hersenletsel.
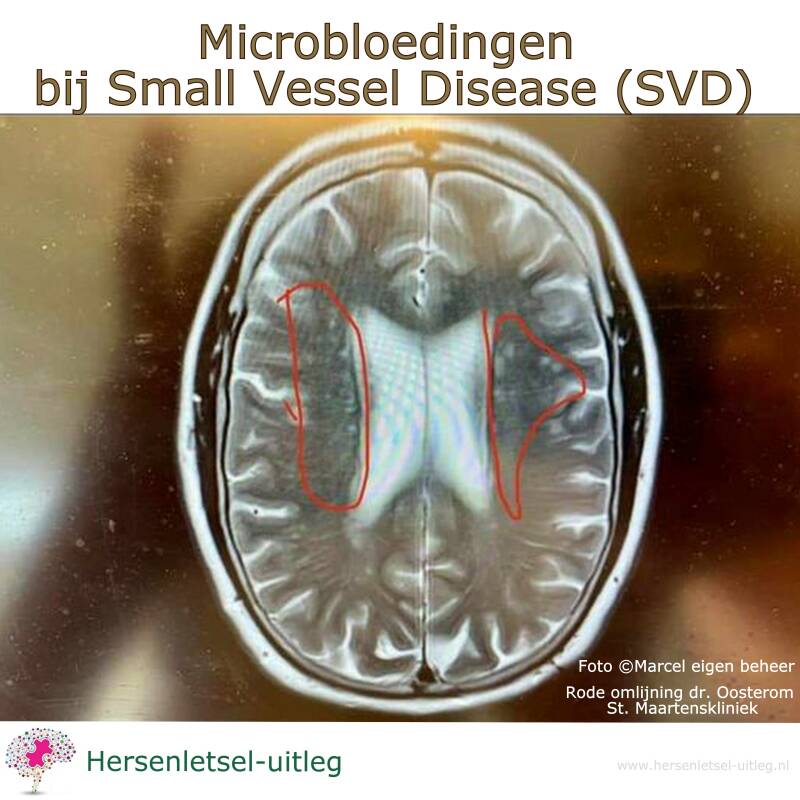
Foto ©Marcel eigen beheer. Dr. van Oosteren St Maartenskliniek heeft de rode lijnen geplaatst om de microbloedingen duidelijk uit te leggen.
Risicofactoren en oorzaken
Hoge bloeddruk (hypertensie) is de belangrijkste risicofactor voor deze cerebrale ziekte van de kleine bloedvaten naast de veroudering van de mens.
Onvoldoende toevoer van bloed naar de hersenen (hypoperfusie) als gevolg van een vernauwing van de gemeenschappelijke halsslagaders is eveneens een grote oorzaak.
De vernauwing komt aan beide kanten van de hals voor (bilaterale stenose). Dit kan zorgen voor meerdere kleine beroertes in bepaalde delen van de hersenen, zoals de hypothalamus, de kleine hersenen, de amygdala en de basale ganglia. Dit kan leiden tot het verlies van hersenweefsel (atrofie).
Andere mogelijke oorzaken die genoemd worden zijn zwaarlijvigheid, roken en slechte slaappatronen. Depressie wordt nu ook erkend als een vasculaire risicofactor.
SVD kan een reactie zijn op ontsteking, maar het is niet bekend welke factor(-en) de overhand hebben in het ontstaan ervan. Een wetenschappelijk onderzoek legde verband tussen systemische ontstekingen in het lichaam op middelbare leeftijd en SVD op latere leeftijd. Dan gaat het om aandoeningen waarbij het afweersysteem ontregeld is en het eigen lichaam aanvalt (auto-immuunziekten).
Wat zijn de klachten van SVD?
- Moeite met denkfuncties (vasculaire cognitieve stoornissen)
- moeite en achteruitgang met denken
- moeite met geheugen, concentratiestoornissen en een verminderd vermogen om problemen op te lossen.
- vertraagde informatieverwerking
- moeite hebben met overzicht houden
- problemen hebben met plannen en organiseren (executieve functies) Zie meer info: cognitieve problemen
- het kan leiden tot vasculaire dementie.
De ernst van deze klachten kan verschillen.
- Problemen met het bewegen, de mobiliteit
- moeite met bewegen en lopen
- parkinsonisme (meer info achter de link). Bijvoorbeeld klachten van een trillende hand of trillende benen of armen, verminderde beweging (hypokinesie), vertraagde bewegingen (bradykinsesie), gestoorde houding, houdingsafwijking, gestoorde houdingsreflexen, verlies van houdingsreflexen en / of stijve ledematen.
balans- en coördinatieproblemen (ataxie), kans op verslikken (dysfagie), moeite met goed articuleren (dysartrie).
Omdat de kleinste bloedvaatjes in de hersenen overal kunnen beschadigen, kunnen heel verschillende klachten ontstaan. Dit hangt af van welk deel van de hersenen beschadigd raakt en wat dat deel doet.
Als iemand bijvoorbeeld schade heeft in het deel van de hersenen dat bewegingen regelt (de motorische schors), kan het logisch zijn dat die persoon moeite heeft met lopen.
Over het algemeen horen we ook van mensen terug dat ze moeite hebben met prikkels. Geluiden komen harder binnen en drukte wordt niet meer verdragen. Dat kan tot overprikkeling leiden en fysiek ziek worden van gewone prikkels.
Vrijwel iedereen heeft, vanaf zestig jaar of ouder, in meer of mindere mate SVD. Niet iedereen heeft daar last van.
Mogelijk gevolg van SVD
Zoals gezegd is SVD één van de oorzaken van vasculaire dementie.
Vasculaire dementie is een vorm van dementie, die door problemen in de doorbloeding van de hersenen veroorzaakt wordt. Als de doorbloeding niet goed verloopt, kan er zuurstoftekort in de hersenen ontstaan. Hierdoor kunnen hersencellen afsterven en kunnen de hersenen problemen krijgen met het verwerken van informatie. Zie meer info op onze speciale pagina over vasculaire dementie.
SVD kan leiden tot een herseninfarct (beroerte) met alle mogelijke gevolgen van hersenletsel nadien, mede afhankelijk van het getroffen hersengebied of functiegebied.
Verschillend verloop; mild, ernstig of zelfs vooruitgang
De impact van een diagnose, of van wat iemand mogelijk in de toekomst nog zal staat te gebeuren, kan iemand erg onzeker maken. Het kan een onveilig gevoel geven. Daarbij is het goed te weten dat SVD zich bij iedereen verschillend kan uiten en dat het verloop niet te voorspellen is. Bij de één verloopt het milder dan bij de ander. Bij sommigen was vooruitgang te zien (zie de linea van het onderzoek van Radboud Universiteit in Nijmegen).
Het is goed om ondersteuning te vragen van bijvoorbeeld individuele begeleiding als het hersenletsel problemen oplevert in het dagelijks leven, of voor verwerking van afgenomen gezondheid. Bijvoorbeeld via de hulp van een POH-GGZ of via psychologische ondersteuning. Als er sprake is van vasculaire dementie is een casemanager dementie de aangewezen persoon voor hulp en ondersteuning. Vraag uw huisarts voor een verwijzing.
Wat kan je zien op een hersenscan?
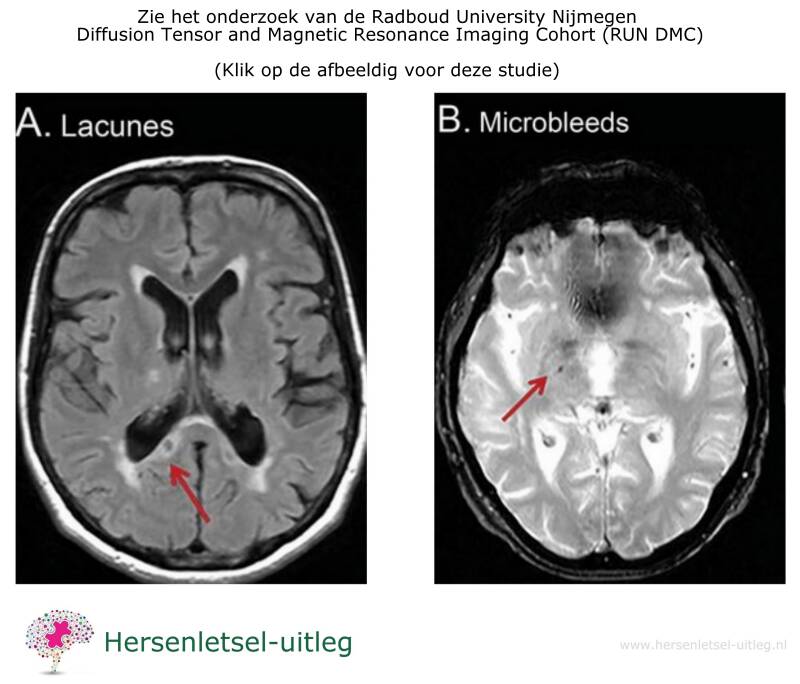
Niet alles is te zien op een hersenscan. Zo zijn kleine bloedvaatjes niet zichtbaar, maar wel schade aan de hersenen, zoals kleine bloedinkjes of afwijkingen in het hersenweefsel (witte stof). Deze schade noemen we 'witte stof afwijkingen'. Ook kunnen er kleine herseninfarcten zichtbaar zijn, zoals lacunaire infarcten (hele kleine infarcten) en andere beschadigingen onder de hersenschors. Daarnaast kunnen de ruimtes rondom de bloedvaten in het hersenweefsel, de zogenaamde 'perivasculaire ruimtes', opvallen.
In het bloed kan het eiwit C-reactief proteïne (CRP) verhoogd zijn. Dit wijst op een ontsteking ergens in het lichaam. Een verhoogde CRP-waarde kan een teken zijn van SVD en neemt toe naarmate de aandoening verder gevorderd is.
Vasculair risicomanagement ter preventie?
Naast het monitoren en behandelen van de vasculaire risicofactoren, zou het volgens wetenschappers aan te bevelen zijn dat er een specifieke polikliniek zou komen voor vaatlijden.
De samenleving moet sterker voorgelicht worden over de risico's van vaatlijden.
"Iemand met SVD ziet nu de neuroloog voor een falende geheugenfunctie en voor andere gevolgen van lacunaire infarcten, de oogarts voor een falend gezichtsvermogen, de nefroloog voor een falende nierfunctie, de cardioloog voor hartfalen en de huisarts en specialist ouderengeneeskunde /geriater voor de controle van vasculaire risicofactoren, wat eigenlijk in één specialisme thuishoort", zegt dr. Hakim van de Universiteit van Ottawa, Canada.Faculteit Brain and Mind Research Institute.
Lees de huidige richtlijnen van het beleid ter voorkoming van- en behandeling van hart- en vaatziekten; cardiovasculair risicomanagement.
Onderzoek Radboud Universiteit Nijmegen
Uit een onderzoek van de Radboud Universiteit Nijmegen, het RUN DMC-project, blijkt dat er bij SVD (small vessel disease) in de hersenen zowel verbeteringen als achteruitgang kunnen optreden na verloop van tijd. Het gaat hierbij om veranderingen in de witte stof, ook wel leukoaraiose genoemd, waarbij deze witte stof zwakker of anders van structuur kan worden.
De witte stof in de hersenen bestaat uit verbindingen (axonen) die ervoor zorgen dat hersencellen met elkaar kunnen praten. Deze verbindingen hebben een beschermlaagje (myeline). Bij SVD raakt dit beschermlaagje beschadigd (demyelinisatie) en gaan de verbindingen zelf stuk.
Uit het onderzoek bleek dat mensen met matige tot ernstige schade aan de witte stof (witte stof hyperdensiteit) een grotere kans hadden dat hun ziekte verder achteruitging. Bij mensen met milde SVD was de schade na 9 jaar ook maar een beetje toegenomen.
Bij 3,6% van de deelnemers herstelden kleine beschadigingen in de hersenen (lacunes) en bij 5,7% verdwenen kleine bloedingen. Toch kon de schade aan de witte stof tegelijkertijd erger worden.
Uit het onderzoek blijkt dat SVD niet lineair achteruitgaat naarmate de tijd verstrijkt.
De snelheid van achteruitgang neemt echter toe met de leeftijd. Daarnaast blijkt dat de progressie van SVD een zeer onvoorspelbaar en wisselend proces is.
Een andere belangrijke bevinding is dat mensen met milde witte stof hyperdensiteit (WMH= white matter hyperdensity) zelden een toename of progressie vertonen gedurende de negen jaar van de studie.
Verschil en overeenkomst met microangiopathie
Small Vessel Disease (SVD) en cerebrale microangiopathie worden vaak in dezelfde context genoemd, omdat ze beide aandoeningen zijn die verband houden met de hele kleine bloedvaten in de hersenen.
Er zijn echter enkele belangrijke overeenkomsten en verschillen tussen de twee. Beide termen worden gebruikt om schade aan de kleine bloedvaten te beschrijven, wat kan leiden tot problemen zoals beroertes, cognitieve achteruitgang en vasculaire dementie.
Het belangrijkste verschil zit in de terminologie:
Small Vessel Disease is een bredere term die wordt gebruikt om verschillende soorten schade aan kleine bloedvaten te beschrijven, inclusief schade veroorzaakt door bijvoorbeeld hoge bloeddruk of diabetes.
Cerebrale microangiopathie daarentegen verwijst specifiek naar de pathologische veranderingen in de kleine bloedvaten van de hersenen, vaak zichtbaar op MRI-scans als witte stofafwijkingen.
Hoewel de oorzaken en gevolgen deels hetzelfde zijn, is cerebrale microangiopathie een term die artsen vaak gebruiken om iets te beschrijven. Small Vessel Disease is meer een term die gaat over hoe het functioneert.
bronnen:
Hersenletsel-uitleg
Hakim AM. Small Vessel Disease. Front Neurol. 2019 Sep 24;10:1020. doi: 10.3389/fneur.2019.01020. PMID: 31616367; PMCID: PMC6768982. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6768982/
Fazekas F, Kleinert R, Offenbacher H, Schmidt R, Kleinert G, Payer F, Radner H, Lechner H. Pathologic correlates of incidental MRI white matter signal hyperintensities. Neurology. 1993;43:1683–1689. [PubMed] [Google Scholar]
Holland PR, Searcy JL, Salvadores N, Scullion G, Chen G, Lawson G, et al.. Gliovascular disruption and cognitive deficits in a mouse model with features of small vessel disease. J Cereb Blood Flow Metab. (2015) 35:1005–14. 10.1038/jcbfm.2015.12 [PMC free article] [PubMed] [CrossRef] [Google Scholar] [Ref list]
Mitaki S, Nagai A, Oguro H, Yamaguchi S. C-reactive protein levels are associated with cerebral small vessel-related lesions. Acta Neurol Scand. (2016) 133:68–74. 10.1111/ane.12440 [PubMed] [CrossRef] [Google Scholar] [Ref list]
Poggesi A, Pasi M, Pescini F, Pantoni L, Inzitari D. Circulating biologic markers of endothelial dysfunction in cerebral small vessel disease: a review. J Cereb Blood Flow Metab. (2016) 36:72–94. 10.1038/jcbfm.2015.116 [PMC free article] [PubMed] [CrossRef] [Google Scholar] [Ref list]
https://www.thelancet.com/journals/laneur/article/PIIS1474-4422(23)00293-4/fulltext :
van Leijsen, Esther & Uden, Ingeborg & Ghafoorian, Mohsen & Bergkamp, Mayra & Lohner, Valerie & Kooijmans, Eline & Holst, Helena & Tuladhar, Anil & Norris, David & Dijk, Ewoud & Rutten-Jacobs, Loes & Platel, Bram & Klijn, Catharina & Leeuw, Frank-Erik. (2017). Nonlinear temporal dynamics of cerebral small vessel disease: The RUN DMC study. Neurology. 89. 10.1212/WNL.0000000000004490.
Brain White Matter: A Substrate for Resilience and a Substance for Subcortical Small Vessel Disease
Walker KA, Power MC, Hoogeyeen RC, Folsom AR, Ballantyne CM, Knopman DS, et al.. Midlife systemic inflammation, late-life white matter integrity, and cerebral small vessel disease: the atherosclerosis risk in communities study. Stroke. (2017) 48:3196–202. 10.1161/STROKEAHA.117.018675 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Wardlaw JM, Smith EE, Biessels GJ, et al. Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration. Lancet Neurol
2013;12:822–838.
Wardlaw JM, Valdés Hernández MC, Muñoz-Maniega S. What are white matter hyperintensities made of? Relevance to vascular cognitive impairment. J Am Heart Assoc. 2015 Jun 23;4(6):001140. doi: 10.1161/JAHA.114.001140. Erratum in: J Am Heart Assoc. 2016 Jan 13;5(1):e002006. PMID: 26104658; PMCID: PMC4599520.
Prins ND, Scheltens P. White matter hyperintensities, cognitive impairment and dementia: an update. Nat Rev Neurol 2015;11:157–165.
Banerjee G, Wilson D, Jager HR, Werring DJ. Novel imaging techniques in cerebral small vessel diseases and vascular cognitive impairment. Biochim Biophys Acta
2016;1862:926–938
By National Cancer Institute, National Institutes of Health - http://training.seer.cancer.gov/anatomy/cardiovascular/blood/classification.html, Public Domain, https://commons.wikimedia.org/w/index.php?curid=45154160
www.scientificanimations.com, CC BY-SA 4.0 <https://creativecommon
Amar K, Bucks R, Lewis T, Scott M, Wilcock G. The Effect of White Matter Low Attenuation on Cognitive Performance in Dementia of the Alzheimer Type. Age Ageing. 1996;25(6):443-8. doi:10.1093/ageing/25.6.443 - Pubmed
Amar K, Lewis T, Wilcock G, Scott M, Bucks R. The Relationship Between White Matter Low Attenuation on Brain CT and Vascular Risk Factors: A Memory Clinic Study. Age Ageing. 1995;24(5):411-5. doi:10.1093/ageing/24.5.411 - Pubmed
Helenius J, Soinne L, Salonen O, Kaste M, Tatlisumak T. Leukoaraiosis, Ischemic Stroke, and Normal White Matter on Diffusion-Weighted MRI. Stroke. 2002;33(1):45-50. doi:10.1161/hs0102.101228 - Pubmed
Pantoni L & Garcia J. Pathogenesis of Leukoaraiosis: A Review. Stroke. 1997;28(3):652-9. doi:10.1161/01.str.28.3.652 - Pubmed
Geerlings M, Appelman A, Vincken K, Mali W, van der Graaf Y, van der Graaf Y. Association of White Matter Lesions and Lacunar Infarcts with Executive Functioning: The SMART-MR Study. Am J Epidemiol. 2009;170(9):1147-55. doi:10.1093/aje/kwp256 - Pubmed
Hachinski V, Potter P, Merskey H. Leuko-Araiosis: An Ancient Term for a New Problem. Can J Neurol Sci. 1986;13(4 Suppl):533-4. doi:10.1017/s0317167100037264 - Pubmed
Grueter B & Schulz U. Age-Related Cerebral White Matter Disease (Leukoaraiosis): A Review. Postgrad Med J. 2012;88(1036):79-87. doi:10.1136/postgradmedj-2011-130307 - Pubmed
Kim K, MacFall J, Payne M. Classification of White Matter Lesions on Magnetic Resonance Imaging in Elderly Persons. Biol Psychiatry. 2008;64(4):273-80. doi:10.1016/j.biopsych.2008.03.024 - Pubmed
Litak J, Mazurek M, Kulesza B, Szmygin P, Litak J, Kamieniak P, Grochowski C. Cerebral Small Vessel Disease. Int J Mol Sci. 2020 Dec 20;21(24):9729. doi: 10.3390/ijms21249729. PMID: 33419271; PMCID: PMC7766314.
Xiong Y & Mok V. Age-Related White Matter Changes. J Aging Res. 2011;2011:617927. doi:10.4061/2011/617927 - Pubmed
Fazekas F, Schmidt R, Scheltens P. Pathophysiologic Mechanisms in the Development of Age-Related White Matter Changes of the Brain. Dement Geriatr Cogn Disord. 1998;9 Suppl 1(Suppl. 1):2-5. doi:10.1159/000051182 -
Prins N & Scheltens P. White Matter Hyperintensities, Cognitive Impairment and Dementia: An Update. Nat Rev Neurol. 2015;11(3):157-65. doi:10.1038/nrneurol.2015.10 -
Lee S, Kim J, Lee K et al. The Leukoaraiosis is More Prevalent in the Large Artery Atherosclerosis Stroke Subtype Among Korean Patients with Ischemic Stroke. BMC Neurol. 2008;8(1):31. doi:10.1186/1471-2377-8-31 - Pubmed
Goodman A. Vladimir Hachinski: A Pioneer in the Field of Stroke. Lancet Neurol. 2009;8(1):34. doi:10.1016/S1474-4422(08)70285-0 - Pubmed
Rosenberg G, Wallin A, Wardlaw J et al. Consensus Statement for Diagnosis of Subcortical Small Vessel Disease. J Cereb Blood Flow Metab. 2016;36(1):6-25. doi:10.1038/jcbfm.2015.172 - Pubmed
Pantoni L. Cerebral Small Vessel Disease: From Pathogenesis and Clinical Characteristics to Therapeutic Challenges. Lancet Neurol. 2010;9(7):689-701. doi:10.1016/S1474-4422(10)70104-6 - Pubmed
Wardlaw J, Smith E, Biessels G et al. Neuroimaging Standards for Research into Small Vessel Disease and Its Contribution to Ageing and Neurodegeneration. Lancet Neurol. 2013;12(8):822-38. doi:10.1016/S1474-4422(13)70124-8 - Pubmed
Haller S, Kövari E, Herrmann F et al. Do Brain T2/FLAIR White Matter Hyperintensities Correspond to Myelin Loss in Normal Aging? A Radiologic-Neuropathologic Correlation Study. Acta Neuropathol Commun. 2013;1(1):14. doi:10.1186/2051-5960-1-14 - Pubmed
Debette S, Schilling S, Duperron M, Larsson S, Markus H. Clinical Significance of Magnetic Resonance Imaging Markers of Vascular Brain Injury: A Systematic Review and Meta-Analysis. JAMA Neurol. 2019;76(1):81-94. doi:10.1001/jamaneurol.2018.3122 - Pubmed
Goeldlin M, Mueller M, Siepen B et al. CADMUS: A Novel MRI-Based Classification of Spontaneous Intracerebral Hemorrhage Associated With Cerebral Small Vessel Disease. Neurology. 2024;102(1):e207977. doi:10.1212/WNL.0000000000207977 - Pubmed
s.org/licenses/by-sa/4.0>, via Wikimedia Commons
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4599520/
#Tags: Vasculaire risicofactoren, dementie, whitematter density, wittestof levensstijl, ontsteking, depressie, microbloedinkjes microbloeding cerebrovasculair lijden, leukoaraiose